
SITE OPTIMISÉ POUR EDGE, MOZILLA FIREFOX et CHROME
AFFICHAGE 1920 X 1080
SITE OPTIMISÉ POUR EDGE, MOZILLA FIREFOX et CHROME
AFFICHAGE 1920 X 1080
SITE OPTIMISÉ POUR EDGE, MOZILLA FIREFOX et CHROME
AFFICHAGE 1920 X 1080

COULEUR ET MINÉRAUX
LA LUMIÈRE & LA COULEUR
Pour la plupart des gemmes et des minéraux, le caractère le plus évident ou l’aspect qui frappe le plus immédiatement l’observateur est la couleur. Les causes de coloration des minéraux sont multiples et la complexité des théories permettant leur étude ne facilite pas la transmission des connaissances sur ce sujet.
La couleur des minéraux est importante lors de leur détermination.
Question : d’où vient la couleur des minéraux ?
Pour bien comprendre les phénomènes physiques liés à la couleur il faut d’abord connaître l’origine de la couleur, c'est-à-dire la lumière.

Fluorite multicolore.
Erzgebirge, Allemagne.
Photo : Cristal and Mineral.
Clic sur le chapitre
LA LUMIÈRE
La lumière est un mouvement ondulatoire ou vibratoire qui se caractérise par des paramètres : la longueur, la fréquence, l’amplitude, la célérité.
Longueur
La longueur est la distance séparant deux maximas successifs, on l'exprime en nanomètres*. Elle varie en fonction de la couleur.
Fréquence
La fréquence est le nombre d’oscillations par seconde.
Amplitude
L’amplitude est fonction de l'intensité lumineuse; la lumière de forte intensité est de grande amplitude, celle de faible intensité est de petite amplitude.
Célérité
Plutôt que de parler de vitesse, puisqu'il n'y pas de transport de matière mais d'énergie, on parle de célérité. Celle-ci s'écrit "c" , elle est égale à :
* nanomètre = milliardième de mètre (0,000 000 001m ) soit millionième de millimètre (0,000 001mm)
d est la distance (mm, ..., km) parcourue pendant une durée t (s, ..., h)
Pour la lumière, dans le vide, sa célérité est de 299 792.458 km.s-1 (prononcer kilomètres par secondes) que l'on arrondit à 300 000 km.s-1 le plus souvent dans le langage populaire.
Dans le vide ou dans les gaz et matériaux homogènes, la lumière se propage en ligne droite. Dans la matière, solides, liquides ou gaz, elle se propage moins vite; on dit de ces milieux qu'ils sont dispersifs, la célérité varie selon la couleur de la lumière. Nous reviendrons à cela en étudiant l'indice de réfraction.

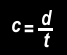
LA TEMPERATURE DE LA LUMIERE
C'est une notion qui qualifie la sensation visuelle et sa chromaticité.
Elles s'expriment en degrés Kelvin dans une bande de 1 000 à 11 000°K .

LA LUMIERE VISIBLE
La lumière visible, appelée aussi spectre visible ou spectre optique est la partie du spectre électromagnétique qui est visible pour l'œil humain.

Rappel de chimie ...

Les électrons, particules du type lepton dont la charge électrique est négative. ils forment un nuage électronique autour des noyaux d'atomes.



Les schémas montrant les électrons en orbites autour des noyaux d'atomes sont une simplification.

Les électrons autour d’un atome n’ont pas réellement de position définie. Ils forment une sorte de nuage autour du noyau, et ils sont constamment à tous les endroits à la fois, avec des probabilités bien définies toutefois. On ne peut pas parler de position, ou de quantité de mouvement, pour une particule, mais seulement de densité de probabilité de présence. Ces probabilités sont calculables avec une énorme précision, grâce à l’équation de Schrödinger. Mais on ne peut jamais dire où se trouve un électron à un instant donné.
C'est pourquoi l'on parle d'orbitale plutôt que d'orbite de l'électron, l'orbitale est la distribution de probabilité de position de l'électron. Pour se faire une image, on a calculé des vitesses prodigieuses d'environ 7.1015 (sept millions de milliards) de révolutions par seconde.
Simplification
Un atome peut avoir jusqu'à 7 orbitales d'électrons désignées par les lettres K à Q du niveau inférieur au niveau supérieur.
Chaque orbitale peut recevoir un maximum d'électrons ainsi répartis :
-
K maximum 2
-
L max 8
-
M max 18
-
N max 32
-
O max 32
-
P max 18
-
Q max 8
La couche K est la seule couche électronique commune à tous les éléments. Ainsi, le nombre de couches électroniques d'un atome dépend du nombre d'électrons de cet atome. Mais la capacité des couches électroniques d'un atome ne laisse pas présager de la répartition par couche de ses électrons. En effet, seuls les 18 premiers éléments chimiques du tableau périodique (de l'hydrogène [Z = 1] à l'argon [Z = 18] suivent un remplissage linéaire tendant vers la saturation de leurs couches électroniques (K, L et M).
Les électrons d’un atomes peuvent avoir plusieurs rôles au sein d’une structure d’atomes :
-
électrons de cœur : ceux-ci sont proche du noyau et n’interagissent pas vraiment avec les autres atomes ;
-
électrons de valence : ceux-ci sont sur les couches externes de l’atome et permettent de créer des liaisons interatomiques et de former les molécules ;
-
électrons de conduction : ceux-ci sont responsables de la circulation du courant électrique.


LES PHOTONS
L’onde électromagnétique est la propagation d'un mouvement vibratoire qui se transmet dans les corps, qu’ils soient gazeux, liquides ou solides. Son vecteur est le photon, un élément de la physique très mystérieux.
En 1926 le chimiste Gilbert Newton Lewis baptise les photons que l’on appelait « quanta de lumière » (paquets de lumière) avant lui. Ce sont les travaux de Maxwell (1865), Planck (1900) et Einstein (1905) qui mettent en évidence l’existence des quantas. Maxwell résout les équations fondamentales des forces électromagnétiques, il démontre que le champ électromagnétique vibre et qu’il se propage à la vitesse de 299 792 km/s que l'on arrondi à 300 000 km par seconde. Puis Planck et Einstein complètent ces travaux par le comportement des quantas. Les photons sont les vecteurs de la force électromagnétique, ce sont des particules d’énergie qui n'ont ni masse, ni charge électrique qui se déplacent en ligne droite leur durée est illimitée .
Ce sont des bosons symbolisé par : ɣ.

L'INTERACTION RAYONNEMENT MATÉRIAU

La lumière est un phénomène physique, photoélectrique, elle est due à l’interaction entre photons et électrons.
Les photons émis par une source lumineuse ont un mouvement rectiligne ondulatoire dont la fréquence grandit avec l’énergie.
Les interactions rayonnement-matériau montrent les conséquences d'un rayonnement sur un atome.
Le terme «rayonnement» est à prendre dans son sens quantique :
-
rayonnement électromagnétique (lumière, rayon X, rayon gamma).
-
particule (électron, neutron, rayonnement alpha).
Ces émissions sont utilisées pour observer la matière.
Les atomes étant trop petits pour être perceptibles, on observe la façon dont ils modifient un rayonnement incident.
L’étude du rayonnement incident permet deux types de procédés d'analyse :
-
la diffraction
-
la spectrométrie
Quels sont les différents cas de figures ?
Le rayonnement électromagnétique, photon, incident agit de plusieurs façons sur un atome :
-
la diffusion
-
l'absorption (ionisation)
Il peut rebondir on dit diffuser :
-
Il rebondit sans perte d'énergie, c'est la diffusion "Rayleigh".
-
Il rebondit en provoquant l'éjection d'un électron faiblement lié, il perd donc de l'énergie, c'est la diffusion "Compton".
Il peut être absorbé, ce qui déclenche une transition électronique, c'est-à-dire le passage d’un électron d’un niveau d’énergie à un autre ; l'atome est excité puisque son état d’énergie change. Il en découle une désexcitation : un électron d'une couche supérieure remplace l'électron éjecté.
-
Lorsque l'énergie incidente est faible, cela provoque simplement le changement d'orbite d'un électron .
-
Lorsque l'énergie est modérée, cela provoque une ionisation, on appelle cela un effet photoélectrique et l'électron éjecté est un photoélectron ; la désexcitation induit l'émission d'un photon de faible énergie (visible ou ultra-violet), c'est le phénomène de fluorescence.
-
Lorsque l'énergie est forte, l’ionisation est semblable au cas d’une énergie modérée; la désexcitation induit deux cas de figure :
-
Soit l’émission d’un photon fluorescent de forte énergie, c’est un photon X, c’est la fluorescence X.
-
Soit ce photon X est capturé par l’atome, provoquant ainsi l’éjection d’un électron périphérique, on appelle celà l’émission Auger.


Sur cette animation le photon rebondit sur l'atome sans perdre d'énergie, sous forme de rayonnement électromagnétique, c'est la diffusion Rayleigh.
Sur cette animation, le rayonnement rebondit et produit l'éjection d'un électron de l'orbite électronique extérieure, donc faiblement lié. Il y a perte d'énergie, c'est la diffusion Compton.

Sur cette animation, l'énergie est suffisante pour provoquer une ionisation, c'est à dire l'éjection d'un photoélectron. Lors de la désexcitation, un électron d'une orbite supérieure vient remplacer l'électron éjecté et un photon de faible énergie est émis, phénomène de fluorescence U-V visible.
Ci-dessous l'énergie de transition est élevée, deux cas se présentent :

1- il y a émission d'un photon fluorescent qui par son énergie est un photon X, c'est le phénomène de fluorescence X.

2- le photon X est capturé par l'atome, ce qui provoque l'éjection d'un électron périphérique, c'est l'émission Auger.

L'INDICE DE RÉFRACTION
L'indice de réfraction d'un matériau s'écrit "n" il est défini ainsi :
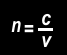
"c" est la célérité de la lumière dans le vide, "v" est la célérité de la lumière dans le matériau.
C'est un nombre positif (>1), puisque "c>v".
Il est fonction de la longueur d'onde de la lumière et du milieu dans laquelle elle se propage.
Plus "n" est grand, plus le matériau est dit réfringent.

Ce tableau montre quelques indices de réfraction dans différents milieux.

Ce tableau montre quelques indices de réfraction dans différents milieux.
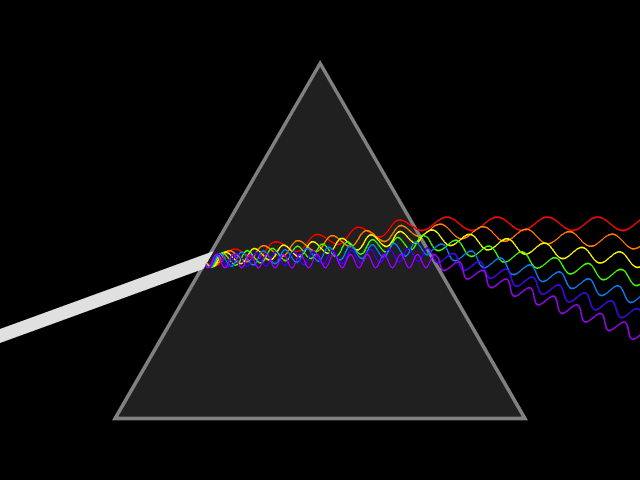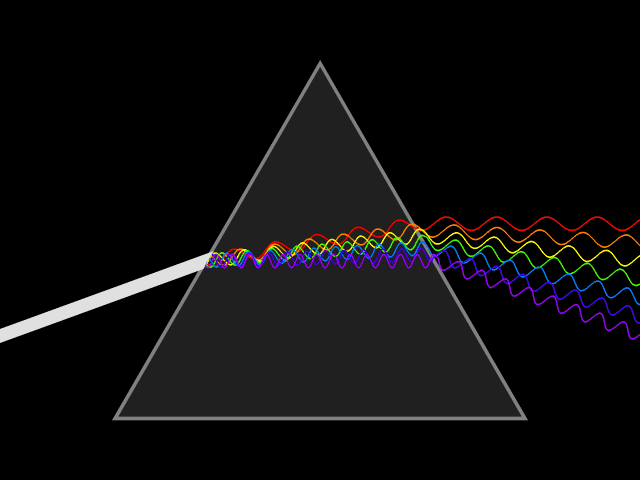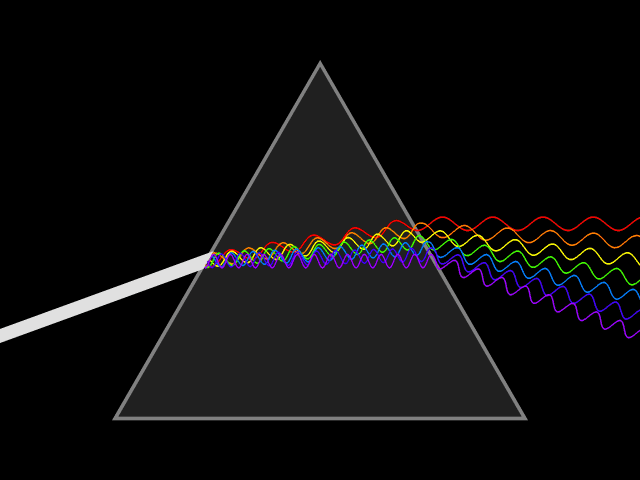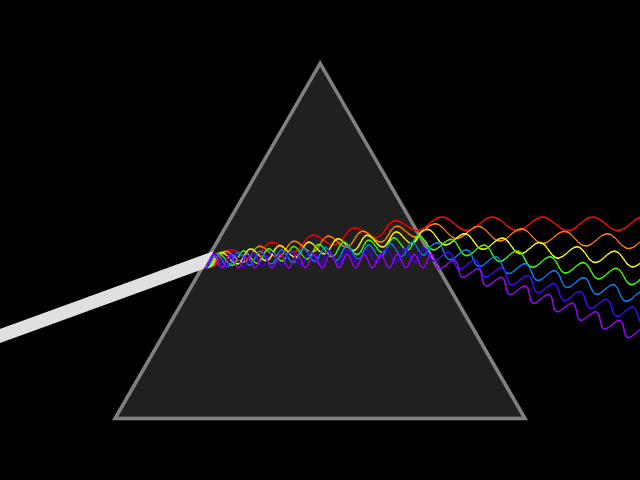
1666 ISAAC NEWTON DECOMPOSE LA LUMIERE EN COULEURS

ORIGINE DE LA COULEUR
Pour la lumière il existe 2 sortes d'objets : les émetteurs et les récepteurs.
Il existe deux sortes d’objets qui émettent de la lumière, ceux qui sont naturels (soleil, étoiles) ou artificiels (systèmes d’éclairage), ils forment les sources primaires. Ils produisent de la lumière blanche qui rayonne alors dans l'univers qui les entoure. L’émission de lumière est due à des réactions au sein de leur source par exemple la lumière solaire est due à la fusion nucléaire.
Les sources secondaires, elles, sont des objets qui reçoivent de la lumière primaire et en renvoient une partie. Un objet de couleur verte «absorbe» toutes les couleurs de la lumière blanche sauf le vert qu’il réfléchit (renvoie).
Les miroirs quant à eux n’absorbent aucune couleur et donc ils les réfléchissent toutes.
La lumière blanche est donc formée de différentes couleurs.
Comment les a-t-on découvertes ?
C’est en 1669 qu’Isaac Newton (1642-1726) découvrit le procédé de décomposition de la lumière.

Diffraction du spectre de la lumière solaire.
Les six couleurs de base de Newton, violet, bleu, vert, jaune, orange et rouge.
From Wikimedia Commons, the free media repository - author :Lucas Vieira
LA LUMIERE VISIBLE
La lumière visible, appelée aussi spectre visible ou spectre optique est la partie du spectre électromagnétique qui est visible pour l'œil humain.

L'œil et la vision des couleurs


Le PDF suivant issu d'un site d'enseignement vous en apprendra beaucoup sur la rétine qui génère et transmet au cerveau des messages sensoriels, je vous recommande de lire ces six pages très illustrées qui vous permettront de mieux comprendre ce qu'est la vision.
La rétine d'un œil humain est tapissée d'environ 130 000 000 de photorécepteurs : 125 000 000 de bâtonnets et 5 000 000 de cônes.
Les bâtonnets permettent la vision en niveaux de gris (sensibles qu'à l'intensité lumineuse), ils sont très utile pour la vision nocturne.
Les cônes permettent la vision des couleurs.
Les cônes demandent une intensité lumineuse assez importante pour remplir leur fonction.
Lorsqu'une émission lumineuse touche les photorécepteurs de la rétine, il y a une des réactions biochimiques qui se transforment en impulsions électriques transmises au cerveau par le nerf optique, qui les interprète alors seulement en termes de couleur.
LE SPECTRE CONTINU DE LA LUMIÈRE BLANCHE
La lumière primaire émise par un objet naturel ou artificiel est donc la lumière blanche qui, lorsqu’elle traverse un prisme se décompose en un faisceau de couleurs appelé spectre (l’arc en ciel). Dans le spectre on passe d’une couleur à l’autre sans « frontière », le spectre est continu.
Chaque couleur est définie par une longueur d’onde, la lumière visible est contenue dans une plage de 400 à 750 nm (nanomètre).
Lorsqu’une lumière colorée ne se décompose pas à travers un prisme elle est monochromatique.



En 1801 Thomas Young (1773-1829), physicien, entreprit le contraire de Newton qui avait décomposé la lumière dans les principales couleurs du spectre en utilisant un prisme, Young lui, recomposa la lumière.
Avec six projecteurs il fit converger six faisceaux de lumière des couleurs du spectre. Ainsi superposées il obtint de nouveau la lumière blanche.
Il fit une autre importante découverte. Il réussit à déterminer que les six couleurs initiales pouvaient être réduites à trois couleurs basiques, Rouge, Verte et Bleue (RVB). Puis il découvrit qu’en mélangeant les couleurs basiques deux par deux on obtenait les trois autres que l’on appellera secondaires, Cyan, Magenta et Jaune.
C’est ainsi que furent déterminées les couleurs primaires et secondaires.
A partir de ces couleurs, leur combinaison peut former des millions d'autres couleurs.
L'animation ci-dessous montre ce que notre œil perçoit lorsqu'un objet de couleur est frappé par un faisceau de lumière blanche.


QUELLE QUANTITÉ DE LUMIÈRE PÉNÈTRE DANS LE MINÉRAL ?
-
Toute la lumière lorsqu'il est transparent.
-
une partie de la lumière lorsqu'il est translucide.
-
aucune lumière lorsqu'il est opaque.

Le lithium Li
On croit souvent que Li est la cause de diverses couleurs dans les minéraux (par exemple la couleur rose lilas de la Kunzite). En réalité il n’en est rien, l’ion Li+ n’est pas responsable de la couleur, mais il accompagne fréquemment d’autres ions tels que l’ion manganèse Mn2+ qui eux, représentent la cause réelle de la couleur.
Le césium Cs
On croit souvent que Cs est la cause de diverses couleurs dans les minéraux. En réalité il n’en est rien, l’ion Cs+ n’est pas responsable de la couleur, mais il accompagne fréquemment d’autres ions tels que l’ion manganèse Mn2+ qui eux, représentent la cause réelle de la couleur.


BIBLIOGRAPHIE EN LANGUE FRANÇAISE:
-
Ancienne Revue " Monde & Minéraux " n° 67, 69 et 70 (article complet de 1985 : " La couleur des minéraux et des gemmes " en trois parties, écrit par Emmanuel Fritsch, Professeur et chercheur C.N.R.S. à l’Institut des Matériaux de L’Université de Nantes, Laboratoire de Physique Cristalline, Equipe Gemmologie).
-
Revue de minéralogie " Le Règne minéral " n° 2 et 3 (article de 1995 : " La couleur des minéraux " en deux parties, écrit par Jacques Galvier)
-
Revue de l’association française de gemmologie (A.F.G.) n° 46 de mars 1976 : traduction française de l’article du chercheur américain Kurt Nassau intitulé " D’où provient la couleur des gemmes et des minéraux ? "
-
Traduction française d’un article de Mr Emmanuel Fritsch (C.N.R.S. Nantes), publiée en Mars 1990 dans la revue " Gemma " de l’association Québécoise de Gemmologie (AQueGem) ; l’article original en anglais est paru dans la revue américaine " Gems & Gemology " Vol. XXIII Number 3.
-
Article intitulé " Le traitement des gemmes " de Mrs Fritsch, Shigley, Lasnier, publié dans la revue " Pour la Science " N° 245 de Mars 1998.
-
Livre " Larousse des pierres précieuses " de P. Bariand et J.P. Poirot (édition de septembre 1998)
SITES INTERNET:
-
http://minerals.gps.caltech.edu (Université américaine de Caltech) Ce site web contient des données sur la couleur des minéraux, dont les gemmes, et des spectres de grande qualité UV-visible-infrarouge.
-
http://scovilphotography.com Jeff Scovil Photography
REMERCIEMENTS :
J’ai été particulièrement sensible à l’aide qui m’a été apporté lors de mes recherches d’informations sur la couleur des minéraux par Mr Fritsch chercheur C.N.R.S. à l’université de Nantes, par Mme Borioli de l’Association Française de Gemmologie, par Mr Bayle directeur de la revue " Le Règne minéral", et enfin par Mr Schwab, ancien responsable du salon minéralogique internationale de Sainte-Marie-aux-Mines.
Jean-Christophe FILLOUX
LA COULEUR DES MINÉRAUX
Pour la plupart des gemmes et des minéraux, le caractère le plus évident ou l’aspect qui frappe le plus immédiatement l’observateur est la couleur. Les causes de coloration des minéraux sont multiples et la complexité des théories permettant leur étude ne facilite pas la transmission des connaissances sur ce sujet.
Les théories permettant l’étude des causes des colorations des cristaux reposent toutes sur de la chimie et de la physique. Dans toutes les causes de coloration décrites dans cet article, à l’exception de la dernière, la clé de la compréhension de la couleur réside dans le comportement des électrons célibataires (présents dans les atomes ou les ions) et dans leur interaction avec la lumière, régie par les conditions restrictives de la théorie quantique. Dans la plupart des minéraux, la couleur provient de l’absorption sélective de la lumière blanche selon différents processus ; dans certains cas plus rares, c’est le cas du dernier mécanisme abordé dans cet article, ce sont des effets d’optique qui créent la couleur.
Des recherches scientifiques récentes ont permis d’identifier six causes spécifiques permettant d’expliquer la couleur des cristaux. Voici donc un rapide tour d’horizon sur les principales causes de coloration, illustrées de quelques exemples. Si vous souhaitez en savoir plus sur ce sujet passionnant, vous trouverez à la fin de l’article, une liste de sources d’informations en langue française.
IDIOCHROMATIQUE

ALLOCHROMATIQUE

CENTRES COLORÉS

TRANSFERT DE CHARGES

THÉORIE DES BANDES DE VALENCE

PSEUDOCHROMATIQUE

ANNEXE :
Les 12 ions métalliques issus de 8 éléments chimiques de transition (sous couche électronique d incomplète) pouvant colorer les minéraux sont : Ti3+ (titane) ; V3+ et V4+ (vanadium) ; Cr3+ et Cr4+ (chrome) ; Mn2+ et Mn3+ (manganèse) ; Fe2+ et Fe3+ (fer) ; Co2+ (cobalt) ; Ni2+ (nickel) ; Cu2+ (cuivre). Les éléments Cérium Ce et Uranium U peuvent être également responsables de colorations..

UNE CRISTALLISATION PEUT ÊTRE MULTICOLORE
Lorsque des éléments chimiques sont présents ou absents lors de la croissance d'un minéral on peut avoir une multitude de couleurs comme ci dessous dans une fluorite.

PODCAST
Cliquez ici.
VIDEO
Since 01-06-2021







